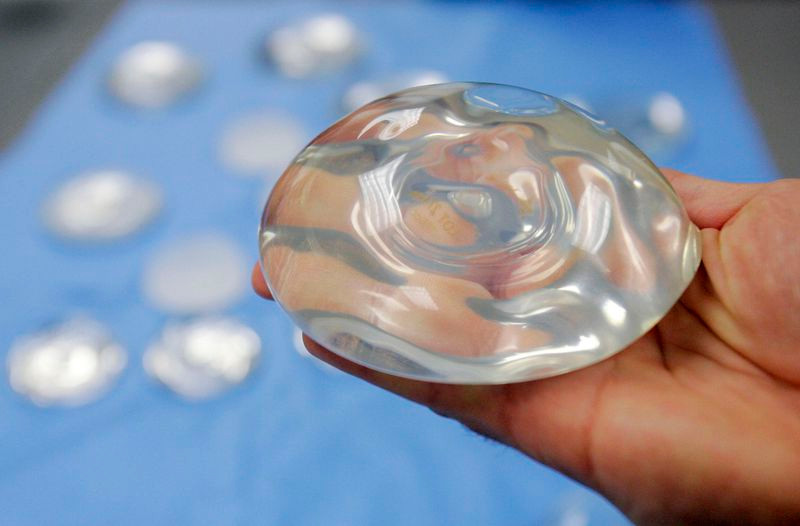
Túi silicon dùng trong phẫu thuật nâng ngực thẩm mỹ. Ảnh: AP
Theo hãng tin AP, FDA đã công bố những quy định mới chủ yếu nhằm vào các nhà sản xuất thiết bị cấy ghép ngực. Theo đó, các nhà sản xuất phải bổ sung thêm thông điệp cảnh báo ở mức nghiêm trọng nhất gửi tới khách hàng.
Các yêu cầu của FDA là bước đi mới nhất trong nỗ lực kéo dài nhiều thập kỷ qua nhằm xử lý vấn đề an toàn thiết bị cấy ghép ngực, chủ yếu được dùng trong các phẫu thuật nâng ngực, loại phẫu thuật thẩm mỹ phổ biến nhất ở Mỹ. Mỗi năm, có khoảng 400.000 người Mỹ phẫu thuật nâng ngực, 100.000 người trong số đó thực hiện sau phẫu thuật ung thư vú.
FDA ban đầu đã đề xuất các quy tắc trên như là các biện pháp tự nguyện vào năm 2019, nhưng hành động mới nhất của cơ quan này đã khiến đây trở thành yêu cầu pháp lý đối với các nhà sản xuất túi ngực, bao gồm những đơn vị hàng đầu như Mentor của Johnson & Johnson và Allergan.
Thay đổi lớn nhất là các bác sĩ phẫu thuật thẩm mỹ và các chuyên gia y tế khác làm việc với mô cấy ghép buộc phải cung cấp cho bệnh nhân của mình một danh sách liệt kê chi tiết các tác dụng phụ tiềm tàng, như sẹo, đau đớn, vỡ rách túi ngực và kể cả nguy cơ mắc một dạng ung thư hiếm gặp. Danh sách này cũng giải thích rằng túi ngực thường đòi hỏi phải phẫu thuật lại và chúng không nên được coi là thiết bị suốt đời.
Các bác sĩ phải ký vào tài liệu và xác nhận rằng người nhận đã xem xét nó trước khi phẫu thuật. Các công ty bán thiết bị cấy ghép cho các bác sĩ không tuân thủ quy định có thể đối mặt với án phạt tiền và các hình phạt khác từ cơ quan quản lý. Các quy tắc mới bắt đầu có hiệu lực sau 30 ngày.
Trong những năm gần đây, FDA và các cơ quan quản lý trên toàn thế giới đã phải vật lộn với lo ngại về mối liên hệ giữa một loại ung thư hiếm gặp và một loại túi cấy ghép. Đó là vấn đề sức khỏe hàng đầu trong số hàng loạt rắc rối mà hàng chục nghìn người đổ lỗi do phẫu thuật cấy ghép gây ra, trong đó có viêm khớp dạng thấp, mệt mỏi kéo dài và đau cơ.
Những lo ngại đó đã khiến FDA triệu tập một cuộc họp tư vấn công khai vào năm 2019, sau đó là các đề xuất mới về cung cấp cho bệnh nhân thêm thông tin về các vấn đề an toàn trước khi phẫu thuật cấy ghép thẩm mỹ.
Quy định của FDA đưa ra các khuyến nghị cập nhật về việc kiểm tra thường xuyên để phát hiện các vết nứt vỡ có thể xảy ra trên thiết bị cấy ghép. Các túi ngực này thường có vỏ ngoài bằng silicon và được làm đầy bằng dung dịch muối hoặc silicone.
FDA cũng sẽ hạn chế chỉ bán và phân phối các thiết bị cấy ghép cho các bác sĩ và cơ sở y tế cung cấp cho bệnh nhân những thông tin chi tiết về an toàn ghi cấy ghép.
“Vấn đề là phải tuyên truyền cho bệnh nhân và đảm bảo rằng họ nhận được thông tin đúng đắn trước khi đưa ra quyết định”, Tiến sĩ Elisabeth Potter, một bác sĩ phẫu thuật thẩm mỹ ở Austin, Texas, nói.
Raylene Hollrah, 48 tuổi, một bệnh nhân sống sót sau ung thư vú, sau đó lại mắc ung thư hạch, được gọi là u lympho tế bào lớn không sản sinh, liên quan đến phẫu thuật đặt túi ngực, cho biết: “Tôi rất vui với thông báo đó. Chúng tôi đã vận động mọi thứ để có được quy định đó ngày hôm nay”.
Mặc dù yêu cầu mới của FDA là một bước đi quan trọng đối với những phụ nữ chuẩn bị cấy ghép ngực, vẫn còn những lo ngại rằng hàng triệu người đã cấy ghép có thể chưa ý thức được về những rủi ro nằm trong cơ thể họ.
“Với những phụ nữ đang định nâng và tái tạo ngực, họ sẽ được thông tin đầy đủ hơn về trải nghiệm của mình. Nhưng điều này không giải quyết được những vấn đề mà nhiều phụ nữ đã cấy ghép ngực khi không được tư vấn hoặc hiểu về tất cả các lựa chọn của họ. Đó là một thách thức”, bà Potter nói.